 Курсовая работа: Биологическая функция нуклеиновых кислот
Курсовая работа: Биологическая функция нуклеиновых кислот
Исследования структуры тРНК методом рентгеноструктурного анализа показали, что их нативные молекулы имеют компактную форму; отдельные двухспиральные "шпильки" клеверного листа складываются в специфическую третичную структуру, которая является близкой для всех тРНК.
После ферментативной этерификации свободной 3'-гидроксигруппы концевого остатка адениловой кислоты в последовательности ССА специфической в отношении тРНК аминокислотой образуется активная форма, называемая аминоацил-тРНК. Остаток этой аминокислоты переносится к концу растущей полипептидной цепи. Антикодон обеспечивает специфичность взаимодействия тРНК с мРНК. Боковые петли, видимо, играют важную роль в связывании тРНК с аминоацил-тРНК-синтетазой и с комплексом рибосома—мРНК. Аддукты аминоцил—тРНК располагаются в определенной последовательности, связанной с последовательностью кодонов мРНК.
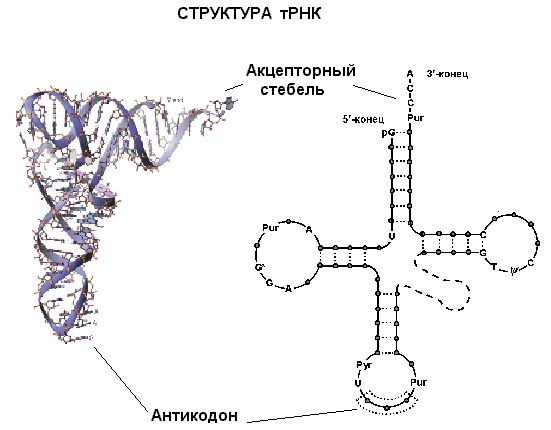
Рис.5 Структура транспортной РНК
Матричная РНК составляет незначительную часть (3—10 %) всех
клеточных РНК; молекулярная масса колеблется в широких пределах и доходит до 14
10![]() . Она
программирует синтез всех клеточных белков цитоплазмы. Относительное содержание
индивидуальной мРНК в суммарном препарате РНК может составлять тысячные доли
процента. Первые экспериментальные доказательства существования мРНК получили
А.Н. Белозерский, А.С. Спирин и их сотрудники (1957—1960 гг.). Они показали,
что нуклеотидный состав общей РНК бактерий E. coli коррелирует с
составом их ДНК, и пришли к заключению о наличии, по крайней мере, двух типов
РНК, один из которых (большая фракция) имеет состав, не отражающий состава ДНК,
а второй (меньшая фракция) воспроизводит состав ДНК. В дальнейшем выяснилось,
что первая фракция — это рибосомная РНК, а вторая — мРНК. Но это сделали в 1961 г. Ф. Гросс и сотрудники.
. Она
программирует синтез всех клеточных белков цитоплазмы. Относительное содержание
индивидуальной мРНК в суммарном препарате РНК может составлять тысячные доли
процента. Первые экспериментальные доказательства существования мРНК получили
А.Н. Белозерский, А.С. Спирин и их сотрудники (1957—1960 гг.). Они показали,
что нуклеотидный состав общей РНК бактерий E. coli коррелирует с
составом их ДНК, и пришли к заключению о наличии, по крайней мере, двух типов
РНК, один из которых (большая фракция) имеет состав, не отражающий состава ДНК,
а второй (меньшая фракция) воспроизводит состав ДНК. В дальнейшем выяснилось,
что первая фракция — это рибосомная РНК, а вторая — мРНК. Но это сделали в 1961 г. Ф. Гросс и сотрудники.
Если рРНК и тРНК метаболически устойчивы, то мРНК в большинстве случаев, особенно у прокариот, является относительно короткоживущей. Ее нуклеотидный состав близок к составу ДНК, выделенной из того же организма. мРНК имеют отчетливо выраженную вторичную структуру; в состав двухцепочечных участков включено до 75 % всех нуклеотидных последовательностей мРНК. Значительная часть участков вторичной структуры в мРНК идентифицирована "шпильками". Однако роль участков вторичной структуры в реализации матричных функций пока точно не установлена. Предполагается, что "шпильки" выполняют роль специфических структур, обусловливающих узнавание определенных участков рибосом при их связывании с мРНК.
Если рРНК и тРНК относятся к обслуживающему аппарату белоксинтезирующей системы клетки, то мРНК является прямым посредником между ДНК и белками, играет роль матрицы для синтеза последних, поэтому считают, что она выполняет роль мессенджера. Сама мРНК синтезируется в ядре клетки в процессе транскрипции у в ходе которой нуклеотидная последовательность одной из цепей хромосомной ДНК ферментативным путем "переписывается" (транскрибируется) с образованием предшественника пре-мРНК; последняя имеет копии палиндромов ДНК, поэтому ее вторичная структура содержит шпильки и линейные участки. При созревании пре-мРНК шпильки отсекаются ферментами и образуется мРНК.
2. Материалы и методы исследований
2.1. Кислотный гидролиз нуклеопротеидов дрожжей и изучение свойств ДНК И РНК
Оборудование и реактивы: весы технические; весы торзионные;
электроплитка; водяная баня; центрифуга; колба на 100 мл с обратным
холодильником; пробирки; пипетки на 1 и 20 мл. Концентрированная и 10%-ная
серная кислота; 10%-ный раствор NaOH; концентрированный
раствор аммиака; 1% раствор AgNO![]() ; бидистиллированная вода; раствор дифениламина (1 г дифениламина растворяют в 50 мл ледяной уксусной кислоты, добавляют 2,75 мл концентрированной H
; бидистиллированная вода; раствор дифениламина (1 г дифениламина растворяют в 50 мл ледяной уксусной кислоты, добавляют 2,75 мл концентрированной H![]() SO
SO![]() и доводят ледяной уксусной кислотой до 100 мл);
молибденовый реактив (18,75 г молибдата аммония растворяют в 250 мл 32%-ного
раствора HNO
и доводят ледяной уксусной кислотой до 100 мл);
молибденовый реактив (18,75 г молибдата аммония растворяют в 250 мл 32%-ного
раствора HNO![]() ); 1%-ный раствор CuSO
); 1%-ный раствор CuSO![]() ; 1%-ный раствор тимола.
; 1%-ный раствор тимола.
Материалы: дрожжи сухие; препараты ДНК и РНК.
Ход работы
1. Гидролиз нуклеопротеидов. В коническую колбу на 100 мл
вносят 1 г сухих дрожжей, добавляют 20 мл 10%-ного раствора H![]() SO
SO![]() и 20 мл бидистиллированной воды. Колбу соединяют с
обратным холодильником, нагревают до кипения и кипятят в течение 1 ч, охлаждают
и центрифугируют 5 мин при 5000 об/мин.
и 20 мл бидистиллированной воды. Колбу соединяют с
обратным холодильником, нагревают до кипения и кипятят в течение 1 ч, охлаждают
и центрифугируют 5 мин при 5000 об/мин.
2. Качественные реакции на пентозы:
а) к 0,5 мл нейтрализованного щелочью гидролизата добавляют 2 капли 1%-ного спиртового раствора тимола, перемешивают и осторожно прослаивают равный объем концентрированной серной кислоты. На дне пробирки образуется красное окрашивание в результате конденсации тимола с фурфуролом, получившимся из пентозы;
б) к 5-10 мг продажного препарата ДНК прибавляют 1 мл 0,4%-ного раствора NaOH, перемешивают. Из полученного раствора отбирают 0,3-0,5 мл раствора дифениламина и ставят на кипящую водяную баню на 10 мин. Жидкость приобретает синий цвет вследствие взаимодействия дезоксирибозы, образовавшейся в результате гидролиза ДНК, с дефиниламином;
в) к 10 мг продажного препарата РНК прибавляют 1 мл 0,4%-ного
раствора NaOH, перемешивают. К 0,5 мл щелочного раствора
РНК добавляют 0,5 мл раствора дифениламина и ставят пробирку на кипящую водяную
баню на 15 мин. Развивается зеленая окраска ![]() жидкости вследствие взаимодействия
рибозы с дефиниламином.
жидкости вследствие взаимодействия
рибозы с дефиниламином.
3. Серебряная проба на пуриновые основания. К 1 мл гидролизата дрожжей приливают 2 капли концентрированного раствора аммиака и 5 капель 1%-ного раствора азотнокислого серебра. Через 3-5 мин выпадает бурый осадок серебряных соединений пуриновых оснований.
4. Молибденовая проба на фосфорную кислоту. К 1 мл гидролизата дрожжей прибавляют 5 капель молибденового реактива и осторожно кипятят несколько минут. Развивается лимонно-желтая окраска жидкости вследствие образования фосфорномолибденовокислого аммония по реакции
H![]() PO
PO![]() + 12 (NH
+ 12 (NH![]() )
)![]() MoO
MoO![]() + 21 HNO
+ 21 HNO![]()
![]() (NH
(NH![]() )
)![]() PO 12 MoO
PO 12 MoO![]() + + 21 NH
+ + 21 NH![]() NO
NO![]() + 12 H
+ 12 H![]() O
O
2.2. Определение нуклеозидфосфатов методом тонкослойной хроматографии
Оборудование и реактивы: СФ; хроматоскоп; весы; рефрижераторная центрифуга; камера для тонкослойной хроматографии; пластинки Silufol uv 254; ножницы; фарфоровые ступки; пробирки; микропипетки; градуированные пипетки на 1 и 2 мл; мерный цилиндр на 100 мл; препаровальная игла. Пропанол; 25%-ный раствор аммиака; жидкий азот; 5%-ный раствор ТХУ кислоты; 0,1 н. HCl; стандартные 0,01 М растворы АТФ, АДФ, АМФ.
Материалы: проростки; ткани животных.
Ход работы
Навеску (0,5 – 1 г) растительной или животной ткани измельчают ножницами на холоду, заливают жидким азотом и растирают в ступке. Затем к растертому порошку приливают 1 мл 5%-ной ТХУ кислоты, перемешивают и центрифугируют 5 мин при 5000 об/мин при 0 - 4° С. Надосадочную жидкость сливают в пробирку, к осадку приливают еще 1 мл 5%-ной ТХУ кислоты, перемешивают и центрифугируют. Супернатанты объединяют и используют для хроматографии. На пластинки Silufol uv 254 в нижней части, отступив 2 см, наносят в виде полосы 0,03 – 0,05 мл насадочной жидкости. После подсыхания ставят в сосуд для восходящей хроматографии. В качестве растворителя используют систему н-пропанол – 25%-ный аммиак – вода (60 : 30 : 10). Время разделения около 2 ч. Затем вынимают хроматографические пластинки, высушивают на воздухе и просматривают в хроматоскопе (светофильтр УФС-1).
Нуклеотиды располагаются в порядке снизу вверх: АТФ, АДФ, АМФ. Зоны, в которых обнаруживаются нуклеотиды, обводят препаровальной иглой, соскабливают в пробирки и экстрагируют 1,8 мл 0,1 н. HCl, интенсивно встряхивают и центрифугируют при 3000 об/мин в течение 5 мин. Надосадочную жидкость фотометрируют в кювете шириной 3 мм при длине волны 257 нм против контроля. Контролем служит соскобленный с пластинки сорбент из золы, не содержащий нуклеотидов; с ним поступают в дальнейшем так же, как с золами, в которых обнаружены нуклеотиды.
Содержание нуклеотидов рассчитывают по калибровочным графикам, составленным для каждого нуклеотида по формуле
C=![]()
где D –
оптическая плотность; В – общий объем экстракта, мл; К – коэффициент экстинкции
(равный для АТФ, АДФ, АМФ соответственно 14,6 10![]() , 15,0 10
, 15,0 10![]() , 14,7 10
, 14,7 10![]() ); А – объем нанесенного экстракта,
мл; n – навеска, г.
); А – объем нанесенного экстракта,
мл; n – навеска, г.
Заключение
В результате выполненной курсовой работы можно сделать вывод, что структурными блоками гигантских молекул нуклеиновых кислот являются нуклеотиды. Каждый нуклеотид содержит три различных компонента: азотистое (пуриновое или пиримидиновое) основание, моносахарид пентозу (рибозу или дезоксирибозу), остаток фосфорной кислоты. Эти компоненты соединены друг с другом в такой последовательности: азотистое основание пентоза — фосфат. Соседние нуклеотиды соединены друг с другом посредством эфирной связи между моносахаридом и фосфатом другого нуклеотида.
Гидролиз нуклеиновых кислот, выделенных из ядер клеток, показал, что они состоят из пуриновых и пиримидиновых оснований (аденина, гуанина, цитозина, тимина), дезоксирибозы и фосфорной кислоты. Эта кислота была названа дезоксирибонуклеиновой (ДНК). Из дрожжей была получена другая нуклеиновая кислота, содержащая вместо дезоксирибозы рибозу. Ее назвали рибонуклеиновой кислотой (РНК). В нее входят основания — аденин, урацил, цитозин и гуанин. ДНК и РНК ответственны за хранение, репликацию (воспроизведение), транскрипцию (перенос) и трансляцию (передачу) генетической (наследственной) информации.
Уникальны биологические функции нуклеотидов. Помимо того, что нуклеотиды входят в состав нуклеиновых кислот, они выполняют важную функцию в энергетическом (фосфорном) обмене, в аккумулировании химической энергии и ее переносе; служат активными простетическими группами в окислительно-восстановительных ферментах, играют важную роль в синтезе жиров, олиго- и полисахаридов.
На основе правил Чаргаффа и данных рентгеноструктурного анализа, Дж. Уотсон и Ф. Крик предложили двухспиральную модель ДНК и развили важную для биохимии концепцию комплементарности. Они предложили три уровня структуры ДНК: первичную (последовательность нуклеотидов), вторичную (структура двух правозакрученных спиралей), третичную (дополнительное закручивание в пространстве двухспиральной молекулы). В образовании вторичной и третичной структур важную роль играют водородные связи, возникающие между парами оснований аденин — тимин и гуанин — цитозин, а также гидрофобные взаимодействия между основаниями, направленные вдоль цепей молекулы ДНК. Разрушение этих связей нагреванием или подщелачиванием растворов вызывает денатурацию ДНК.
Точное копирование молекулы ДНК (ее репликацию) обеспечивает так называемый полуконсервативный механизм, заключающийся в расхождении двух цепей материнской ДНК и использовании их в качестве матриц для синтеза двух новых (дочерних) цепей ДНК, Этот механизм доказан экспериментально.
РНК — однонитевые молекулы, в отличие от ДНК; их вторичная и третичная структуры нерегулярны. По своим биологическим функциям РНК подразделяются на три типа: рибосомная — рРНК, транспортная — тРНК и матричная — мРНК. рРНК входит в состав клеточных органелл — рибосом. Данный тип РНК участвует в формировании структуры рибосом, на которых осуществляется синтез белка. тРНК выполняют функцию переносчика аминокислот к месту синтеза белка. мРНК передает считанную ею информацию с ДНК на синтезируемый белок, выполняет роль матрицы при синтезе полипептидной цепи.
Список использованной литературы
1. Жеребцов Н. А., Попова Т. Н., Артюхов В. Г. Биохимия: Учебник. — Воронеж: Издательство Воронежского государственного университета, 2002.
2. Землянухин А.А. Практикум по биохимии: учебн. пос — Воронеж: Издательство Воронежского государственного университета, 1993.
3. Зенгер В. Принципы структурной организации нуклеиновых кислот. — М: Мир, 1987.
4. Ленинджер А. Основы биохимии: Учебник. — М.: Мир, 1985.
5. Остерман Л. А. Методы исследования белков и нуклеиновых кислот. — М.: Наука, 1981.
6. Плешков Б.П. Биохимия сельскохозяйственных растений: Учебник. — М.: Агропромиздат, 1987.


