 Реферат: Анализ азота и его соединений
Реферат: Анализ азота и его соединений
Метиловый красный, 0,1%-ный раствор. Растворяют 0,1 а натриевой соли метилового красного в 100 мл 96%-наго спирта.
Смешанный индикатор. Смешивают 2 объема 0,2%-наго раствора метилового красного в 96%-ном спирте с 1 объемом 0,2%-наго раствора метиленовой синей в 96%-ном спирте.
Реактив Несслера (приготовление - см. «Колориметрическое определление с реактивом Несслера»).
Ход определения. В перегонную колбу отмеривают 10-500 мл, в зависимости от ожидаемого содержания аммиака, пробы, которую при необходимости разбавляют бидистиллятом приблизительно до 250 мл. Если необходимо, смесь нейтрализуют 1 н. раствором едкого натра (определяется индикаторной бумагой). Пробы, которые подще- лачивались при отборе, нейтрализовать не надо.
В приемник, который представляет собой колбу для титрования емкостью 500 мл, наливают 25 мл серной кислоты соответствующей нормальности или 25 мл 2%-ного раствора борной кислоты и доливают бидистиллят так, чтобы конец холодильника был погружен в жидкость.
В перегонную колбу прибавляют 100 мл фосфатного буферного раствора. Значение рН смеси в колбе не должно отличаться более чем на ±0,2 от рН 7,4. Для установления рН в некоторых случаях приходится прибавлять большее количество буферного раствора - до 40 мл на 100 мл пробы (биологически очищаемые сточные воды
и др.). Фекальные и сточные воды не подщелачивают буферным раствором, а добавляют 20 мл 40%-ного раствора едкого натра.
В приемник отгоняют около 200-100 мл жидкости. При использовании аппарата Парнаса - Вагнера в приемник перегоняют с водяным паром не менее 50 мл дистиллята, опускают приемник и собирают по каплям еще около 5 мл дистиллята. Затем прерывают перегонку и конец, холодильника ополаскивают бидистиллятом.
Аммиак, перегнанный в приемник, определяют объемным или колориметрическим методом. При определении объемным методом с применением серной кислоты дистиллят титруют раствором едкого натра соответствующей концентрации по метиловому красному или со смешанным индикатором. Титровать надо раствором той же нормальности, какой был применен для поглощения аммиака. Параллельно определяют количество раствора щелочи, расходуемое на титрование 25 мл кислоты, помещенной в приемник. Титрование ведут до получения такой же окраски индикатора.
При определении объемным методом с применением борной кислоты проводят холостой опыт (25 мл раствора борной кислоты титруют 0,02 н. раствором серной кислоты по метиловому красному или со смешанным индикатором). Дистиллят титруют тем же титрованным раствором до такой же окраски, какая была получена при титровании холостого опыта.
При колориметрическом определении содержимое приемника обрабатывают 1 н. кислотой до рН 6, переливают в мерную колбу емкостью 250 мл и объем доводят до метки бидистиллятом. В 50 мл раствора определяют аммиак способом, указанным при непосредственном колориметрическом определении аммиака реактивом Нес- слера .
Расчет. Содержание NH+4 в мг/л (х) или мг-экв (у) вычисляют следующими способами.
При определении объемным методом с поглощением серной кислотой по формулам:
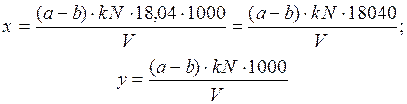
где а - объем раствора едкого натра, израсходованного на титрование 25 мл раствора серной кислоты, мл; b - объем раствора едкого натра, израсходованного на титрование дистиллята, мл; k - поправочный коэффициент к нормальности титрованного раствора едкого натра; N - нормальность титрованного раствора едкого натра; V - объем пробы, взятой для определения, мл; 18,04 - эквивалент NH+4.
При определении объемным методом с поглощением борной кислотой вычисление проводят по тем же формулам, используя следующие обозначения: а - объем 0,02 н. раствора серной кислоты, израсходованного на титрование дистиллята, мл; b - объем 0,02 н. раствора серной кислоты, израсходованного на титрование в холостом опыте, мл; k - поправочный коэффициент к нормальности титрованного раствора серной кислоты; N - нормальность титрованного раствора серной кислоты .
При определении колориметрическим методом вычисляют по фор мулам:
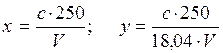
где с - концентрация аммиака, найденная во калибровочному графику, мгал. V - объем пробы, взятой для определения при перегонке, мл; 18,04 - эквивалент NH+4; 250 - объем разбавленной пробы.
Округление результатов. Результаты, полученные при объемном определении, округляют до 0,1 мг в области до 10 мг/л и до целых миллиграммов в области до 100 мг/л и т. д. Результаты колориметрического определения округляют так же, как при непосредственном колориметрическом определении с реактивом Несслера.
По найденному общему содержанию аммиака можно рассчитать концентрации аммиака и NH+4, если известно значение рН воды. Найденное общее содержание аммиака надо выразить в мг-экв/л и по табл. 2 найти концентрации NH3 и NH+4 в мг-экв/л. Умножив полученные величины соответственно на 17,03 и 18,04, можно получить концентрации NH3 и NH+4 в мг/л.
Таблица 2. Относительное содержание NH3 в воде, %
|
|
pH |
||||||||
|
t,°C |
6 |
7 |
8 |
8,5 |
9 |
9,5 |
10 |
10,5 |
11 |
|
25 |
0,05 |
0,49 |
4,7 |
13,4 |
32,9 |
60,7 |
83,1 |
93,9 |
98,0 |
|
15 |
0,02 |
0,23 |
2,3 |
6,7 |
19,0 |
42,6 |
70,1 |
88,1 |
96,0 |
|
5 |
0,01 |
0,11 |
0,9 |
3,3 |
9,7 |
25,3 |
51,7 |
77,0 |
91,5 |
Содержание NH+4 (в %) находят, вычитая из 100% указанное в таблице содержание NH3.
Таблица составлена для ионной силы раствора, равной 0,025, что приблизительно отвечает общему содержанию солей, равному 1 г/л. Колебания в величине ионной силы сравнительно мало отражаются на представленных в таблице величинах. Влияние температуры весьма значительно, особенно при средних значениях pH.
НИТРИТЫ
Нитриты являются промежуточным продуктом биохимического окисления аммиака или восстановления нитратов. Их присутствие свидетельствует о фекальном загрязнении вод. В поверхностных водах нитриты быстро переходят в нитраты. Они присутствуют в концентрациях от нескольких микрограммов до десятых долей миллиграмма в 1 л. В большем количестве они находятся в некоторых промышленных и биологически очищенных сточных водах.
Для определения
нитритов в питьевых, поверхностных н сточных водах предлагается колориметрический
метод с сульфаниловой кислотой и ![]() -нафтиламином.
-нафтиламином.
Вследствие нестойкости нитритов их надо определять сразу же после отбора пробы. Если это невозможно, пробу консервируют добавлением 1 мл концентрированной H2SO4, или 2-4 мл хлороформа на 1 л. Можно также охлаждать пробу до 3-4° С.
Результаты
определения выражают в миллиграммах нитрит- ионов в 1 л, а при больших концентрациях - в мг-экв в 1 л: 1 мг ![]() = 0,02174 мг-экв
= 0,02174 мг-экв ![]() ; 1 мг-экв
; 1 мг-экв ![]() =
46,005 мг
=
46,005 мг ![]() .
.
Качественное определение
К 10 мл пробы прибавляют 1 мл раствора сульфаниловой кислоты и 1 мл раствора а-нафтиламина (приготовление - см. ниже). В присутствии нитритов появляется розовая или красно-фиолетовая окраска. Чувствительность определения составляет около 0,01 мг нитритов в 1 л воды.
Страницы: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14


