 Реферат: Лечение внебольничной пневмонии
Реферат: Лечение внебольничной пневмонии
При подозрении на пневмонию, вызванную атипичными возбудителями, назначаются пероральные макролиды. Альтернативой макролидам могут быть респираторные фторхинолоны (лефофлоксацин, моксифлоксацин).
У госпитализированных больных с нетяжелой пневмонией возможно назначение как парентеральных, так и пероральных препаратов. Показаниями к парентеральной терапии являются: тяжелая пневмония, нарушение сознания, нарушение глотательного рефлекса, функциональные или анатомические причины нарушенного всасывания [9]. При нетяжелой пневмонии возможно использование амоксициллина/клавуланата, ампициллина, парентеральных цефалоспоринов II и III поколений (цефтриаксон, цефуроксим аксетил, цефатаксим), альтернативными препаратами являются внутривенные макролиды (кларитромицин, спирамицин) или респираторные фторхинолоны. При подозрении на аспирационный генез пневмонии назначают амоксициллина/клавуланат или комбинацию b-лактамов с метронидазолом или клиндамицином.
При тяжелой пневмонии в качестве стартовой терапии назначают комбинацию цефалоспоринов III поколения (или амоксициллина/клавуланата) и макролидов. По данным нескольких ретроспективных исследований, такой режим терапии может сопровождаться снижением летальности, что объясняется не только активностью комбинации препаратов к типичным и атипичным микроорганизмам, но и способностью макролидов уменьшать противовоспалительный эффект бактериальных продуктов [19]. Альтернативным режимом является комбинация цефалоспоринов III поколения и фторхинолонов (офлоксацин, ципрофлоксацин). При подозрении на инфекцию Legionella spp. к указанным препаратам добавляют парентеральный рифампицин. При высоком риске инфекции P. aeuruginosa (муковисцидоз, бронхоэктазы), эмпирическая антимикробная терапия должна включать цефалоспорины III поколения с антисинегнойной активностью (цефтазидим, цефипим) или карбапенемы (имипенем, меропенем) в комбинации с ципрофлоксацином или аминогликозидами (табл. 5).
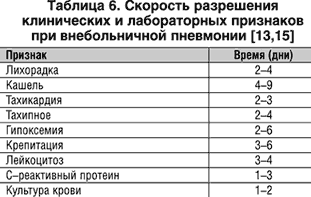
Ответ на антимикробную терапию зависит от иммунной реактивности организма, тяжести заболевания, причинного патогена, протяженности пневмонии по данным рентгенографической картины. Субъективный ответ на антибиотики обычно наблюдают в течение 1–3 суток от начала терапии. Объективный ответ включает оценку лихорадки, других симптомов, лабораторных показателей и рентгенографических изменений. Средняя динамика объективных параметров показана в таблице 6.
После получения адекватного ответа на парентеральное введение антимикробных препаратов возможен переход на пероральные препараты. Такой подход определяют как «ступенчатая» терапия, если используется один и тот же антибиотик, или как «последовательная» терапия, если производится замена одного парентерального антибиотика на другой пероральный препарат. Использование ступенчатой или последовательной терапии позволяет значительно уменьшить расходы на лечение и сократить длительность пребывания больных в стационаре. Пероральный антибиотик при последовательной терапии должен обладать высокой биодоступностью. Для ступенчатой терапии чаще используют макролиды, фторхинолоны, амоксициллин/клавуланат, цефуроксим. При последовательной терапии возможен переход от в/в ампициллина на амоксициллин, от в/в цефалоспоринов на амоксициллин/клавуланат или другие пероральные цефалоспорины (цефподоксим, цефиксим).
Критериями перехода от в/в к пероральной терапии являются:
Разрешение лихорадки > 24 часов
Пульс < 100 мин-1
Разрешение тахипное (ЧД < 20 мин-1)
Хорошая гидратация, способность к приему жидкости per os
Отсутствие гипотензии
Отсутствие гипоксемии
Снижение лейкоцитоза периферической крови
Отсутствие бактериемии
Отсутствие микробиологических данных за инфекции Legionella spp., Staphylococcus aureus и грамотрицательные бактерии
Адекватная абсорбция из желудочно–кишечного тракта
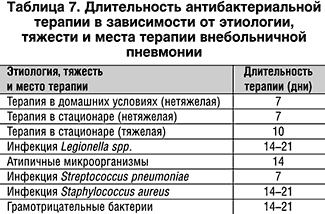
Длительность антимикробной терапии зависит от тяжести заболевания, этиологического фактора, наличия или отсутствия осложнений. Средняя длительность терапии представлена в таблице 7.
Терапия осложнений внебольничной пневмонии
Антибактериальные препараты являются основой терапии больных с пневмонией, однако в ситуации ведения больных с тяжелой пневмонией, важнейшее значение играет терапия, направленная на терапию осложнений пневмонии (острая дыхательная недостаточность, септический шок, абсцесс и др.) [1].
При умеренной гипоксемии (SpO2 85–90%), при условии достаточного респираторного усилия больного, сохраненного сознании и быстрой обратной динамики инфекционного процесса, возможна коррекция гипоксемии при помощи простой носовой маски (FiO2 до 45–50%) или маски с расходным мешком (FiO2 до 90%). Показания в респираторной поддержке рассматриваются на основании клинической картины с учетом газометрических показателей:
нарушение сознания (сопор, кома);
нестабильная гемодинамика;
признаки дисфункции дыхательной мускулатуры;
частота дыхания > 35 мин-1;
рН артериальной крови < 7,3;
РаО2/FiO2< 250 мм рт.ст.
Альтернативой традиционной респираторной поддержке является неинвазивная вентиляция легких (НВЛ) с помощью лицевых масок, НВЛ позволяет улучшить газообмен у 75% больных и избежать интубации трахеи у 60% больных с тяжелой пневмонией. Применение НВЛ при тяжелой пневмонии обосновано у больных с фоновым заболеванием ХОБЛ, при условии хорошего дренирования дыхательных путей и на ранних этапах развития ОДН [1]
Особую сложность представляет проблема проведения вентиляционного пособия больным с ОДН на фоне унилатерального (несимметричного) поражения легких. Предложено несколько подходов для улучшения оксигенации у больного с односторонней пневмонией: использование фармакологических препаратов (альмитрин, ингаляционный оксид азота NO); периодическое придание больному положения на здоровом боку (decubitus lateralis); раздельная вентиляция легких с учетом разного комплаенса и различной потребности РЕЕР в здоровом и «больном» легком [11].
У больных с тяжелым сепсисом и септическим шоком на первом этапе терапии назначают растворы для восполнения объема циркулирующей жидкости (чаще коллоиды). В ряде случаев введения растворов может быть достаточно для коррекции циркуляторных нарушений, в случае их неэффективности назначают допамин, а затем при неэффективности – вазоконстрикторы (норадреналин, адреналин) и инотропные препараты (добутамин) [22]. При «рефрактерном» септическом шоке, при подозрении на недостаточность надпочечников (больные с предшествующим приемом стероидов) возможно использование низких доз глюкокортикостероидов (гидрокортизон 100 мг 3 раза в сутки в течение 5–10 дней).
Абсцесс легкого определяется, как локализованный участок некроза ткани легких, приводящий к образованию одиночных или множественных полостей размерами более 2 см [10]. Причиной развития большинства абсцессов легких является смешанная флора, причем анаэробная инфекция встречается до 90% случаев, либо как первичный патоген, либо в комбинации с аэробами. Терапия абсцесса легкого слагается из антимикробной терапии и (редко) бронхоскопических и хирургических методов лечения. К основным антибактериальным препаратам, назначаемым при абсцессах легких, относятся: клиндамицин, «защищенные» пенициллины: амоксициллин/клавуланат (Амоксиклав), ампициллин/сульбактам, тикарциллин/клавуланат, клиндамицин. Рекомендуемая длительность антибактериальной терапии больных с абсцессом легких составляет 1–3 месяца.
Дренирование абсцессов часто достигается путем обеспечения хорошей экспекторации мокроты и использования физиотерапевтических процедур (перкуссия, вибрационный массаж), бронхоскопических методов. Хирургическое вмешательство может понадобиться при больших размерах абсцесса (более 6 см) и при осложнениях абсцесса (легочное кровотечение, формирование бронхоплевральной фистулы).
Парапневмонические плевральные выпоты могут значительно различаться по тяжести течения, варьируя от неосложненного выпота до развития эмпиемы плевры. Некоторые формы парапневмонического выпота не требуют специальной терапии, кроме антибактериальной терапии, в то время, как при эмпиеме может потребоваться хирургическое вмешательство. Биохимический анализ плеврального выпота позволяет разграничить три стадии парапневмонического плеврального выпота на основании трех параметров: рН, ЛДГ и глюкозы [16] (табл. 8).

Терапия парапневмонического плеврального выпота прежде всего зависит от его стадии и риска неблагоприятного исхода [13] (рис. 1). При неосложненном выпоте показано наблюдение и антимикробная терапия. При осложненном плевральном выпоте показано проведение торакоцентезов при помощи повторных пункций или установка дренажной трубки. При эмпиеме методом выбора является дренирование плевральной полости. При наличии спаечного процесса в плевральной полости и осумкованных полостей адекватное дренирование плевральной полости может быть достигнуто при введении в нее фибринолитиков, которые позволяют растворить фибриновые сгустки и мембраны. Торакоскопия является альтернативным методом фибринолитикам для терапии осумкованных плевральных выпотов [13].
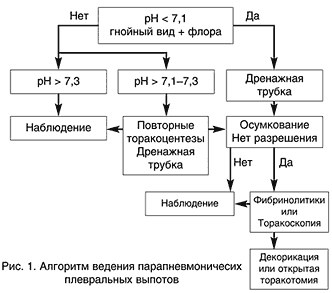
Рис. 1. Алгоритм ведения парапневмоничесих плевральных выпотов
Поддерживающая терапия при внебольничной пневмонии
Больные с пневмонией, госпитализированные в стационар, особенно, в отделения интенсивной терапии, как правило, нуждаются в проведении поддерживающей терапии, которая включает растворы, электролиты, питание, бронхолитики, отхаркивающие препараты. Тяжелым больным, особенно с ОДН, дегидратацией, наличием в анамнезе тромбоэмболий и не имеющим противопоказаний к терапии прямыми антикоагулянтами, для профилактики венозных тромбозов назначают низкие дозы нефракционированного гепарина (п/к 5.000 ед 2–3 р/сут) или, предпочтительнее, низкомолекулярные гепарины (эноксапарин п/к 40 мг/сут) [20].
Список литературы
1. Авдеев СН. Осложнения внебольничной пневмонии. В книге: Пневмония. Под редакцией АГ Чучалина, АИ Синопальникова, НЕ Чернеховской. Москва, Экономика и информатика, 2002: 134–181.
2. Козлов РС, Кречикова ОИ, Сивая ОВ, и кол. Антимикробная резистентность Streptococcus pneumoniae в России: результаты проспективного многоцентрового исследования (фаза А проекта ПеГАС–I). Клин Микробиол Антимикр Химиотер 2002; №3: 267– 277.
3. Навашин СМ, Чучалин АГ, Белоусов ЮБ, и др. Антибактериальная терапия пневмоний у взрослых. Клин Фармакол Терапия 1999; 8(1): 41– 50.
4. Страчунский ЛС. Антимикробная терапия внебольничной пневмонии в условиях поликлиники. С. 341– 363. В книге: Пневмония. Под редакцией АГ Чучалина, АИ Синопальникова, НЕ Чернеховской. Москва, Экономика и информатика, 2002.
5. Чучалин АГ, Синопальников АИ, Яковлев СВ, и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике. Пособие для врачей. Смоленск 2003, 53с.
6. American Thoracic Society. Guidelines for the initial management of adults with community–acquired pneumonia: diagnosis, assessment of severity, and initial antimicrobial therapy. Am Rev Respir Dis 1993; 148: 1418– 1426.
7. American Thoracic Society. Guidelines for the management of adults with community–acquired pneumonia. Diagnosis, assessment of severity, antimicrobial therapy, and prevention. Am J Respir Crit Care Med 2001; 163: 1730– 1754.
8. Bartlett JG, Dowell SF, Mandell LA, et al. Pracice guidelines for the management of community–acquired pneumonia in adults. Clin Infect Dis 2000; 31: 347– 382.
9. British Thoracic Society. British Thoracic Society guidelines for the management of community–acquired pneumonia in adults. Thorax 2001; 56(suppl IV): iv1– iv64.
10. Cassire HA, Niederman MS. Aspiration pneumonia, lipoid pneumonia, and lung abscess. In: Pulmonary diseases. Ed: Baum GL, Crapo JD, Celli BR, Karlinsky JB. Lippincot–Raven, Philadelphia, New York, 1998: 645– 655.
11. Dreyfuss D, Djedaini K, Lanore JJ, et al. A comparative study of the effects of almitrine bismesylate and lateral position during unilateral bacterial pneumonia with severe hypoxemia. Am Rev Respir Dis 1992; 146: 295– 299.
12. Farr BM, Sloman AJ, Fisch MJ. Predicting death in patients hospitalized for community acquired pneumonia. Ann Intern Med 1991; 115: 428– 436.
13. Fein A, Grossman R, Ost D, Farber B, Cassiere H. Daignosis and management of pneumonia and other respiratory infections. Professional Communications, Inc., 1999: 288p.
14. Fine MJ, Smith MA, Carson CA, et al. Prognosis and outcome of patients with community–acquired pneumonia: a meta–analysis. JAMA 1996; 275: 134– 141.
15. Halm EA, Fine MJ, Marrie TJ, et al. Time to clinical stability in patients hospitalized with community–acquired pneumonia: implications for practice guidelines. JAMA 1998; 279: 452– 1457.
16. Heffner JE. Infection of the pleural space. Clinics Chest Med 1999; 20: 607– 622.
17. Huchon G, Woodhead M. Management of adult community–acquired lower respiratory tract infections. Eur Respir Rev 1998; 8: 391– 426.
18. Ortqvist A. Treatment of community–acquired lower respiratory tract infections in adults. Eur Respir J 2002; 20(Suppl.36): 40s–53s.
19. Rello J, Catalan M, Diaz E, et al. Associations between empirical antimicrobial therapy at the hospital and mortality in patients with severe community–acquired pneumonia. Intensive Care Med 2002; 28: 1030– 1035.
20. Samama MM, Cohen AT, Darmon J–Y et al., A comparison of enoxaparin with placebo for the treatment of venous thromboembolism in acutely ill medical patients. N Engl J Med 1999; 341: 793– 800.
21. Sitbon O, Mercat A, Petitretz P. Pneumopathies aiguёs infectieuses. Salmeron S, Duroux P, Valeyre D (Ed). Pneumologie. Medecine–Sciences. Flammarion, Paris, 1997: p 232– 247.
22. Wheeler AP, Bernard GR. Treating patients with severe sepsis. N Engl J Med 1999; 340: 207– 214.
23. Woodhead M. Community acquired pneumonia in Europe: causative pathogens and resistance patterns. Eur Respir J 2002; 20: 20s– 27s.


